Molécule cible

Synthèse originale
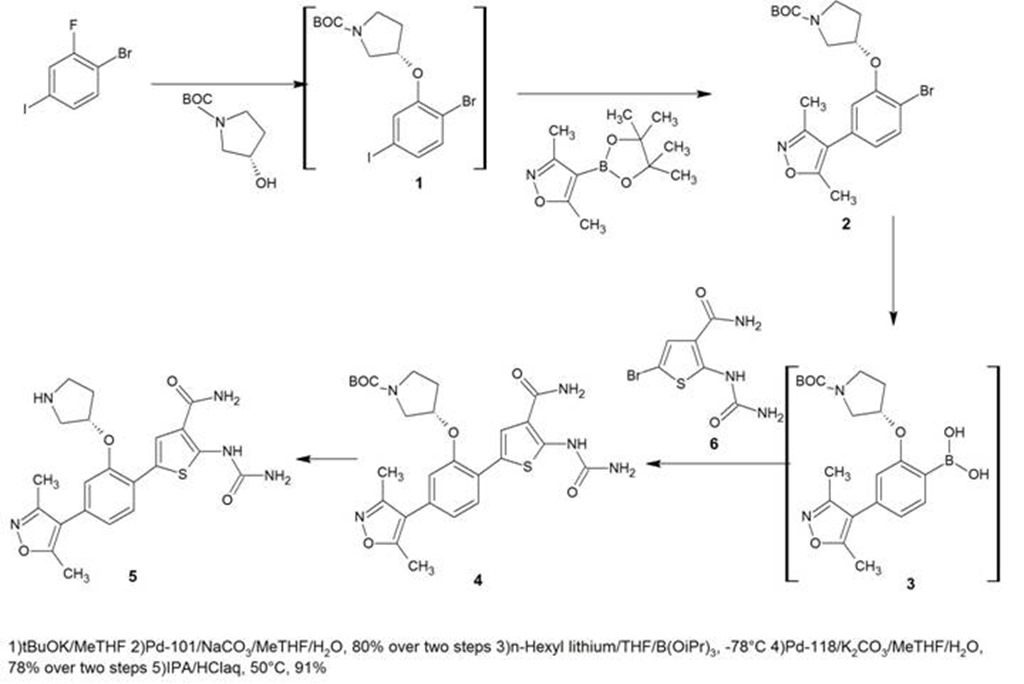
Exploiting the Differential Reactivities of Halogen Atoms: Development of a Scalable Route to IKK2 Inhibitor AZD3264, Pharmaceutical Development, AstraZeneca India Pvt. Ltd, Hebbal, OffBellary Road, Bangalore 560024, India, Org. Process Res. Dev.2014, 18, 646−651Détails da la publication ici: http://newdrugapprovals.org/2015/05/15/azd-3264-an-ikk2-inhibitor-from-astra-zeneca/
Mots clés: Substitution nucléophile aromatique, Isoxazole, réduction, diazotation, amino-thiophène, chloration, couplage C-C, hydrolyse.
La synthèse est déjà optimisée (route 3), mais il reste encore quelques problèmes:
- L’utilisation de dérivés boroniques qui sont aujourd’hui classés comme mutagènes, s’ils peuvent être évités, ce serait mieux,
- Le dérivé Isoxazole est dispendieux (1260$/kg – prix Molbase),
- Conditions cryogéniques pour préparer le dérivé boronique (3) qui est par ailleurs instable et préparé avec du n-hexyle lithium,
- Le procédé décrit dans le brevet pour le composé (6) (un produit maison) utilise un réactif toxique pour préparer le 2-[(aminocarbonyle)amino]: chlorosulfonylisocyanate.
- Couplage C-C métallique au Palladium que personnellement je n’aime pas trop utiliser à grande échelle
Optimisation proposée:
Le dérivé Isoxazole représentant la plus grosse part dans le coût en matières premières, étant potentiellement mutagène et requérant un couplage au Palladium, le coût en matières premières de départ peut être réduit jusqu’à hauteur de 84% en choisissant de préparer l’Isoxazole sans couplage au Palladium. D’autre part on peut éviter des conditions cryogéniques (-78°C) et l’utilisation du n-hexyle lithium en passant par un sel de diazonium.Le point négatif est que cela rajoute 2 étapes, celles de la préparation de l’Isoxazole. Cependant, elles peuvent être effectuées en one-pot. De plus, si un pré-traitement est effectué avant la ArSNX pour installer la partie pyrrolidinol, il y a 3 stades enchaînés sans isolement. Ceci couplé à la réduction du coût en matière premières, l’ajout de charges fixes et variables liées aux 2 étapes supplémentaires peut être absorbé (voir Costing).
Dernièrement, bien que ce soit exploratoire, il y a possibilité de remplacer le couplage au Palladium du thiophène par un couplage au Fer III et un organomagnésien désactivé (une méthode sera publiée dans Réactions & Méthodes).
Il y a enfin différentes possibilités à chaque stade de pouvoir revenir sur la voie d’origine, ce qui peut réduire le temps d’étude.
La contrainte globale pour que cette voie soit intéressante est un rendement globale de 57% et un ajout maximale de charges de 1336$/kg (308$/mol).
En supplément, et dans l’optique d’utiliser des réactifs moins nocifs, j’ai modifié un peu la préparation du thiophène à partir du 2-amino-3-cyanothiophène, qui est un produit déjà fabriqué par Astra-Zeneca, qui utilise actuellement du chlorosulfonylisocyanate un réactif très toxique. Il y a par ailleurs la possibilité d’inverser le dérivé boronique pour le couplage C-C si celui-ci fonctionne.
Voie de synthèse proposée
Détails
Pour obtenir une orientation en para, il faut un contrôle thermodynamique avec une base faible et un solvant polaire tel que le NMP (ou le N-butylpyrrolidinone en remplacement car moins nocif) ou le DMSO, un CTP si nécessaire et une température de réaction appropriée. La référence ci-dessous indique une très bonne sélectivité en position para dans ces conditions.
Dans le cas où cette réaction ne serait pas très performante, il peut être envisagé d’utiliser le p-fluoro,o-chloro-nitrobenzene (675$/kg, 118.49$/mol) et la pentane-2,4-dione (110$/kg, 11.02$/mol). Cependant ceci augmente de 4.36 fois le coût en matières premières pour cette partie.
Référence:
Nucleophilic Substitution of Hydrogen in Arenes and Heteroarenes, Metal Free C-H Functionalization of Aromatics, Top Heterocycl Chem (2014) 37: 51–106.
Préparation de l’Isoxazole (8) (one-pot possible)
Très probablement, en ajoutant le sulfate d’hydroxylamine sur le milieu, la cyclisation se produit. Si la fin de réaction est un peu difficile, elle peut être amenée jusqu’à complétion par élimination de l’eau (avec du sulfate de sodium anhydre par exemple), qui est de toute façon nécessaire si cette réaction est enchaînée avec l’étape suivante.
À la fin de cette réaction, en filtrant les sels inorganiques (sels de carbonate, bicarbonates et sulfates), le milieu est prêt pour la réaction suivante.
Référence:
Efficient and Regioselective One-Pot Synthesis of 3-Substituted and 3,5-Disubstituted Isoxazoles, S. Tang, J. He, Y. Sun, L. He, X. She, Org. Lett., 2009, 11, 3982-3985.
2nd substitution nucléophile aromatique (9) (one-pot possible)
Très probablement, en utilisant les conditions mentionnées dans la route originale, la réaction doit se faire. Par ailleurs, si un on-pot est considéré, l’ArSNX citée dans la référence ci-dessous est effectuée dans un solvant polaire (MeTHF ou tBuOH). Probablement qu’en utilisant le NMP avec le tBuOK comme base, la réaction se fait aussi avec les même résultats.
Le groupe protecteur Boc serait possiblement à modifier s’il ne résiste pas aux conditions de post-traitement pour une réaction enchaînée dans l’étape N+1 et N+2 (extraction de l’amine en milieu acide faible aqueux et diazotation en milieu acétique). S’il doit être remplacé, idéalement, il faudrait que ce soit un groupe formyle qui s’enlèverait dans les conditions de la dernière étape.
Références:
Exploiting the Differential Reactivities of Halogen Atoms: Development of a Scalable Route to IKK2 Inhibitor AZD3264, Pharmaceutical Development, AstraZeneca India Pvt. Ltd, Hebbal, OffBellary Road, Bangalore 560024, India, Org. Process Res. Dev.2014, 18, 646−651.
Total Syntheses of AF-2785 and Gamendazole—Experimental Male Oral Contraceptives, Arava Veerareddy, Gogireddy Surendrareddy & P. K. Dubey, Synthetic Communications Volume 43, Issue 16, August 2013, pages 2236-2241.
Réduction du groupe nitro (10)
La réaction peut très certainement se faire dans un milieu biphasique eau/solvant organique en vue de la prochaine étape. L’agent réducteur serait du dithionite de sodium, le solvant organique serait à déterminer en fonction de la solubilité de (9) et (10) sous forme d’amine libre.
Pour des raisons évidentes, le post-traitement afin d’éliminer les sels de bisulfites et de dithionites doit se faire en conditions basiques (production de dioxyde de soufre et de thiosulfate pouvant corroder l’acier inox en milieu acide), de même que les conditions réactionnelles doivent être en milieu moyennement basiques avec du carbonate. Idéalement (mais pas nécessairement), l’eau utilisée doit être apyrogène (qui peut être préparée par la méthode de Schlenk).
Une fois les sels inorganiques éliminés, l’amine peut être extraite en milieu acide faible pour la prochaine étape, à condition que le Boc résiste. Il faut probablement utiliser une solution aqueuse d’acide acétique titrée pour limiter la cinétique de déprotection du Boc si elle se produit en milieu concentré.
Références:
Fast and effective reduction of nitroarenes by sodium dithionite under PTC conditions: application in solid-phase synthesis, Tetrahedron Letters, 54,(2013), p2600-2603.
The reduction of aromatic nitro groups on solid supports using sodium hydrosulfite (Na2S2O4), Tetrahedron Letters, 41, (2000), p6531-6535.
Diazotation-halogénation/borylation (11) (semi one-pot si le traitement dans l’étape précédente est effectué)
À la solution aqueuse de l’étape précédente, ajouter le nitrite de sodium, ajuster les quantité d’acide acétique pour la diazotation. Si le sel de diazonium est instable, un échange de sel peut être fait avec le tosylate ou le tétrafluoroborate via une résine échangeuse d’ions (mais ceci ajoute un coût), et ajouter le KI pour préparer le dérivé iodo. Puisque le groupement protecteur est un N-Boc, le HCl ou le TsOH ne sont pas recommandés.
À partir du sel de diazonium, en ajoutant l’acide diboronique, on revient sur la voie originale en obtenant le composé (3).
Par ailleurs, on peut également envisager un couplage C-C directement avec le sel de diazonium ou le bromé et un dérivé boronique du thiophène.
Références:
A Green Procedure for the Diazotization–Iodination of Aromatic Amines under Aqueous, Strong-Acid-Free Conditions, Marina E. Trusova, Elena A. Krasnokutskaya, Pavel S. Postnikov, Younghwa Choi, Ki-Whan Chi, Victor D. Filimonov, Synthesis 2011(13), 2154-2158
Iodination of stable aromatic diazonium salt using crosslinked poly (4-vinylpyridine)-supported iodide, Mohammad Ali Karimi Zarchi* andNahid Ebrahimi, Journal of Applied Polymer Science, Volume 124, Issue 4, pages 2807–2813, 15 May 2012.
Kinetic investigation of diazotization reaction in benzotriazole with dead-stop-end-point method, Flora Shayegh*, Fatemeh Hair, Seyed Mehdi Kamali Shahri, Petroleum & Coal 51 (1), 13-17, 2009.
Sandmeyer avec CuBr cat/KBr:
Catalytic Sandmeyer Bromination, Irina P. Beletskaya*, Alexander S. Sigeev, Alexander S. Peregudov, Pavel V. Petrovskii, I. P. Beletskaya, A. S. Sigeev, A. S. Peregudov, P. V. Petrovskii, Synthesis, 2007, 2534-2538.
Sandmeyer borylation:
Methanol-Promoted Borylation of Arylamines: A Simple and Green Synthetic Method to Arylboronic Acids and Arylboronates, C.-J. Zhao, D. Xue, Z.-H. Jia, C. Wang, J. Xiao, Synlett, 2014, 25, 1577-1584.
Couplage C-C de Suzuki avec un sel de diazonium:
Synthesis of a Novel C2-Symmetric Thiourea and Its Application in the Pd-Catalyzed Cross-Coupling Reactions with Arenediazonium Salts under Aerobic Conditions, M. Dai, B. Liang, C. Wang, J. Chen, Z. Yang, Org. Lett., 2004, 6, 221-224.
Suzuki-Miyaura Cross-Coupling of Arenediazonium Salts with Arylboronic Acids Catalyzed by a Recyclable Polymer-Supported N-Heterocyclic Carbene-Palladium Catalyst, Y. Qin, W. Wei, M. Luo, Synlett, 2007, 2410-2414.
Suzuki-Miyaura Reactions of Arenediazonium Salts Catalyzed by Pd(0)/C. One-Pot Chemoselective Double Cross-Coupling Reactions, R. H. Taylor, F.-X. Felpin, Org. Lett., 2007, 9, 2911-2914.
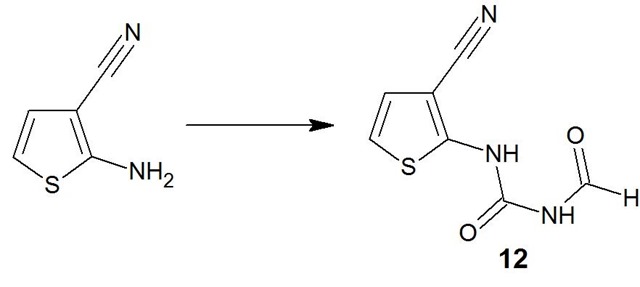
Préparation du dérivé 2-[(aminocarbonyl)amino] (12)
Au lieu d’utiliser un réactif toxique, je suis pratiquement sûr qu’un traitement du 2-amino-3-cyano-thiophène avec du carbonyldiimidazole suivi de l’addition de formamide donne le 2-[(aminocarbonyl)amino] protégé.
Référence:
Unprecedented “In Water” Imidazole Carbonylation: Paradigm Shift for Preparation of Urea and Carbamate, Department of Medicinal Chemistry, Nycomed Pharma Pvt. Ltd., 29-31 Suren Road, Andheri east, Mumbai-400 092, India, Org. Lett., Vol. 14, No. 11, 2012.
Préparation du dérivé 5-chloro-thiophène (13)
Une intéressante publication utilise du NCS avec du chlorure de Fer III dans l’acetonitrile pour l’halogénation. Puisque un catalyseur au Fer III (acetylacetonate ou chlorure) peut être utilisé pour le couplage C-C dans l’étape suivante, un test de faisabilité et un screening de solvants (avec et sans catalyseur puisqu’il y a une dimérisation possible, voir plus bas), doit être faite pour fournir une solution utilisable après un traitement pour enlever la succinimide.
Dans la publication, le thiophène est utilisé en présence de chlorure de Fer III, et il y a seulement de la polymérisation. Puisque la position 2 est substituée, il y aurait peut-être une dimérisation. En raison de l’effet des substituants sur le cycle, la méthode devrait être testée pour voir s’il n’y a que l’halogénation qui se produit dans ces conditions.
Si ça ne fonctionne pas, au lieu d’utiliser le nitrate d’ammonium (qui un tantinet « pétatoire ») utiliser la procédure dans le brevet WO 2001058890 A1 dans le DMF.
Dernièrement il y a la procédure standard NCS/AcOH.
Si le choix d’inverser l’acide boronique pour le couplage C-C est fait, et ainsi d’avoir le dérivé bromé de (11) ou de faire le couplage directement sur le sel de diazonium, le NBS doit être utilisé pour faire ensuite un échange halogène/organomagnésien désactivé, pour obtenir l’acide boronique correspondant en faisant réagir le triméthyle borate.
Références:
Halogenation of Aromatic Compounds byN-chloro-, N-bromo-, and N-iodosuccinimide, Kiyoshi Tanemura, Tsuneo Suzuki, Yoko Nishida, Koko Satsumabayashi, and Takaaki Horaguchi, Chemistry Letters Vol.32, No.10 (2003).
Pour le dérivé boronique:
Noncryogenic I/Br-Mg Exchange of Aromatic Halides Bearing Sensitive Functional Groups Using i-PrMgCl-Bis[2-(N,N-dimethylamino)ethyl] Ether Complexes, X.-J. Wang, X. Sun, L. Zhang, Y. Xu, D. Krishnamurthy, C. H. Senanayake, Org. Lett., 2006, 8, 305-307.
Couplage C-C (14)
Comme mentionné précédemment, il y a plusieurs possibilités:
- Réaction de couplage avec l’aryle sous forme d’acide boronique obtenu par le sel de diazonium
- Réaction de couplage avec le thiophényle sous forme d’acide boronique
Dans mes différents rapports, j’ai mentionné l’utilisation d’un Grignard désactivé pour faire un échange halogène/organomagnésien en présence de groupes fonctionnels sensibles. D’autre part, au cours de mes lectures, je me suis intéressé au couplage avec le Fer III avec et sans organomagnésien.
Faits:
- Dans les réactions catalysées au Fer III avec un Grignard, si du chlorure de Fer III est utilisé, du Tétraméthyléthylène diamine doit être ajouté pour éviter de l’homocouplage et avoir un gain de rendement. De plus, les Grignards ne réagissent pas sur les groupes fonctionnels sensibles tels que les esters ou les nitriles dans ces conditions.
- Quand un Grignard est désactivé par complexation avec le bis[2-(N,N-dimethylamino)-ethyl] ether, ils ne réagissent pas sur les esters ou les nitriles (de même que les cétones).
- Dernièrement, quand de l’acétylacétonate de Fer III est utilisé, il n’y a pas besoin d’ajouter du Tétraméthyléthylène diamine et il n’y a pas de réactions envers les esters et nitriles.
Le TMEDA doit jouer le même rôle que le bis[2-(N,N-dimethylamino)-ethyl] ether qui est un agent désactivant du Grignard. L’acétylacétonate doit également jouer ce rôle dans la réaction. Toutefois, celui-ci étant en quantité catalytique car seulement apporté par le catalyseur, son action reste limitée mais suffisante compte tenu de la cinétique de couplage.
Méthode possible (sera développée dans Réactions & Méthodes):
Habituellement, un couplage C-C au Fer III avec un Grignard se fait avec un aryle halogéné et une chaine alkyle portant l’organomagnésien.
Pour cette 3ème possibilité, ce serait d’effectuer dans un premier temps un échange halogène/Grignard sur (11) en présence du bis[2-(N,N-dimethylamino)-ethyl] ether (ou l’ajouter après). J’ai choisi le dérivé iodo en raison du substituant en ortho qui augmente la densité électronique sur le noyau aromatique, qui rend l’échange plus difficile. Cette partie peut se faire entre 0°C et température pièce.
Avant le couplage, il faut éliminer l’halo-alkyle issu de cet échange par distillation (à volume constant), soit à pression ordinaire, soit à pression réduite dépendamment de la stabilité du Grignard. C’est pourquoi le choix du Grignard est important, car l'halo-alkyle correspondant peu faire un azéotrope avec le solvant si celui-ci est également bien choisie. Ainsi il ne serait pas nécessaire de faire un « In Process Control » afin de vérifier que l’halo-alkyle est bien éliminé.
Par la suite on peut ajouter le catalyseur, soit le chlorure soit l’acetylacetonate (ma préférence), puis ajouter sur le milieu sur un temps donné, pour contrôler la réaction, le dérivé thiophène.
Généralement, les couplages au Fer III d’un aryle Grignard substitué donnent des rendements plus faibles qu’à partir d’alkyl Grignards. Toutefois, le dérivé thiophène possédant des groupes électro-attracteurs et le dérivé aryle des groupes électro-donneurs, on est dans une configuration pour une bonne réaction.
Références:
Noncryogenic I/Br-Mg Exchange of Aromatic Halides Bearing Sensitive Functional Groups Using i-PrMgCl-Bis[2-(N,N-dimethylamino)ethyl] Ether Complexes, X.-J. Wang, X. Sun, L. Zhang, Y. Xu, D. Krishnamurthy, C. H. Senanayake, Org. Lett., 2006, 8, 305-307.
Iron-Catalyzed Cross-Coupling Reactions, A. Fuerstner, A. Leitner, M. Méndez, H. Krause, J. Am. Chem. Soc., 2002, 124, 13856-13863.
Iron-Catalyzed Reactions in Organic Synthesis, Carsten Bolm,* Julien Legros, Jacques Le Paih, and Lorenzo Zani, Chem. Rev.2004,104,6217−6254.
Iron Catalyzed C-C Coupling Reactions: Mechanistic Investigations, Anna Hedström, Thesis, 2013 (reference therein n°38).
Hydrolyse et déprotection finale (5)
L’hydrolyse acide du nitrile est un peu “violente” (acide sulfurique concentré), mais elle donne (5) en enlevant le formyle, le N-Boc et hydrolysant le nitrile.
La dernière étape de déprotection de l’amine utilise un mélange IPA/HCl aqueux. Ces conditions peuvent aussi enlever le formyle, l’hydrolyse du nitrile doit être faite sur un temps de réaction plus long.
Si l’hydrolyse pose un problème, elle peut être réalisée en milieu basique en utilisant l’Amberlyst A26 dans le mélange IPA/eau, suivie par une filtration pour enlever la résine puis ajouter le HCl aqueux pour enlever le Boc et le formyle.
Référence:
Amberlyst A26 OH as a Recyclable Catalyst for Hydration of Nitriles and Water-Based Synthesis of 4(1H)-Quinazolinones from 2-Aminobenzonitrile and Carbonyl Compounds, Fatemeh Tamaddon,* Farzaneh Pouramini, Synlett 2014, 25, 1127–1131.
Costing
Ceci est seulement une comparaison des matières premières de départ principales (solvant exclus) entre les deux voies de synthèses (prix Molbase).Synthèse originale (5 étapes): 1766 $/kg (368.4$/mol)
- Trihalo benzene: 195 $/kg (58.67$/mol)
- Isoxazole: 1260 $/kg (281.08$/mol)
- N-hexyle lithium: 311 $/kg (28.65$/mol)
Voie alternative (7 étapes en excluant la préparation de 13): 430 $/kg (60$/mol)
- 1-Chloro-2-nitrobenzene: 27$/kg (4.25$/mol)
- 1-Chloropentane-2,4-Dione: 358 $/kg (48.17$/mol)
- Hydroxylamine: 25$/kg (4.1$/mol)
- Sodium Dithionite: 10$/kg (1.74$/mol)
- Sodium nitrite: < 10$/kg (< 1.74$/mol)
Avertissement
Ceci est un travail personnel réalisé sur papier uniquement et basé sur une étude bibliographique. Je ne suis aucunement responsable si quelqu’un souhaite essayer cette voie de synthèse et procédés, et rencontre toutes sortes de problèmes tels que blessures corporelles ou pertes pécuniaires, la liste n’étant pas exhaustive. Cette étude pouvant servir de base de travail est destinée à des chimistes expérimentés uniquement. Les essais doivent être effectués dans un laboratoire avec les installations appropriées garantissant la sécurité des manipulations et des individus.© David Le Borgne, 2015, spécialiste en développement et optimisation de procédés de synthèses.
![clip_image002[7] clip_image002[7]](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEintVCA7iCKxKwQEQbon01R57o1Ew7dXXSsDALrYF9wLXW5X47wHBlturZQU2VzvS9aApAcjIvcoS1zwj9daM6UymWk1YxM0C911SV4RAkX34rguH5ekOVVvqeuq_THLH6JUoBqio_P2JTf/?imgmax=800)








Aucun commentaire:
Publier un commentaire