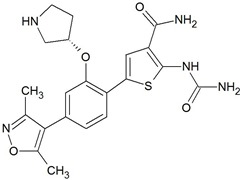
Molécule cible
Mots clés: Substitution nucléophile aromatique, isoxazole, réduction, diazotation, amino-thiophene, chloration, couplage C-C, hydrolyse.
Rapport complet ici
Synthèse originale

Exploiting the Differential Reactivities of Halogen Atoms: Development of a Scalable Route to IKK2 Inhibitor AZD3264, Pharmaceutical Development, AstraZeneca India Pvt. Ltd, Hebbal, OffBellary Road, Bangalore 560024, India, Org. Process Res. Dev.2014, 18, 646−651
Détails da la publication ici: http://newdrugapprovals.org/2015/05/15/azd-3264-an-ikk2-inhibitor-from-astra-zeneca/
La synthèse est déjà optimisée (route 3), mais il reste encore quelques problèmes:
- L’utilisation de dérivés boroniques qui sont aujourd’hui classés comme mutagènes, s’ils peuvent être évités, ce serait mieux,
- Le dérivé isoxazole est dispendieux (1260$/kg – prix Molbase),
- Conditions cryogéniques pour préparer le dérivé boronique (3) qui est par ailleurs instable et préparé avec du n-hexyl lithium,
- Le procédé décrit dans le brevet pour le composé (6) (un produit maison) utilise un réactif toxique pour préparer le 2-[(aminocarbonyle)amino]: chlorosulfonylisocyanate.
- Couplage C-C métallique au Palladium que personnellement je n’aime pas trop utiliser à grande échelle
Optimisation proposée:
Pour:- 84% de réduction potentiel sur le coût matières premières
- Élimination des conditions cryogéniques en passant par un sel de diazonium
- Élimination de l’utilisation du n-hexyl lithium
- Élimination d’un couplage C-C au Palladium
- Remplacement du couplage au Palladium restant par un couplage au Fer III
- 2 étapes de plus mais qui peuvent être faites en one-pot
- Rendement minimum pour la synthèse totale: 57%
- Charges (fixes et variables) additionnelles maximales pour les 2 étapes supplémentaires: 1336$/kg (308.4$/mol)
Les deux étapes supplémentaires concernent l’isoxazole. Au lieu d’acheter le dérivé boronique de l’isoxazole qui est dispendieux, potentiellement mutagène et d’utiliser un couplage C-C au Palladium, j’ai choisi de le préparer via une substitution nucléophile aromatique avec son précurseur (évite le couplage C-C au Pd), sur un noyau aromatique substitué par un groupe Nitro favorisant la ArSNH. Le groupe Nitro sert par ailleurs de précurseur d’une fonction amine servant à la diazotation, conduisant ainsi soit à un dérivé halogéné, soit au dérivé boronique (3) (permettant de revenir sur la route originale), évitant par la même occasion le stade cryogénique et l’utilisation de l’hexyl lithium.
La cyclisation de l’isoxazole se faisant avec l’hydroxylamine (peu cher), ces 2 stades supplémentaires peuvent se faire en on-pot.
Enfin, la seconde ArSNX peut se faire également en one-pot à condition de neutraliser d’abords le carbonate et bicarbonate et assécher le milieu. Si ces 3 réactions peuvent être enchaînées, les charges fixes sont diminuées notablement en éliminant 2 isolements. Ce dernier point additionné à un bas coût de la matière première (dérivé chloro-nitro), l’ensemble peut s’aligner sur les contraintes financières induites par le rendement global minimum et le coût additionnel maximum.
La partie délicate est la formation du sel de diazonium sans déprotéger l’amine aliphatique. L’utilisation de l’acide acétique en lieu et place de l’acide chlorhydrique pourrait corriger le problème. Si toutefois le Boc est trop fragile dans ces conditions, il faut utiliser un autre groupe protecteur facile à enlever qui soit résistant à des conditions acide à 0°C ou à température pièce. Le groupe formyle remplie ces conditions.
D’autre part, si la diazotation est difficile avec l’acide acétique, ET que le groupe protecteur de l’amine est un formyle, l’acide chlohydrique peut être utilisé à 0°C sans risques. Toutefois à température pièce, à mon avis, il ne faut pas que la cinétique pour installer l’halogène ou le Bore soit trop lente.
Le second couplage au Pd pourrait être remplacé par un couplage au Fer III en utilisant un organomagnésien désactivé, soit sur (11) soit sur (13) dépendamment de l’efficacité. Il est a noter que de la polymérisation est observée lors de l’utilisation du Fer III avec le thiophène, cependant, celui-ci étant substitué en 2, il ne pourrait y avoir que de l’homocouplage, ce dernier pouvant être évité en utilisant un agent de complexation de l’organomagnésien et du Fe(acac)3 (développement d’une méthode de couplage au Fer III avec un organomagnésien désactivée dans un autre rapport dans Réactions & Méthodes).
Le stade final d’hydrolyse de la fonction nitrile peut également servir de déprotection de la fonction amine et de la partie urée.
Rapport complet ici
Costing
Ceci est seulement une comparaison des matières premières de départ principales (solvant exclus) entre les deur voies de synthèses (prix Molbase).Synthèse originale (5 étapes): 1766 $/kg (368.4$/mol)
- Trihalo benzene: 195 $/kg (58.67$/mol)
- Isoxazole: 1260 $/kg (281.08$/mol)
- n-hexyl lithium: 311 $/kg (28.65$/mol)
Voie alternative (7 étapes en excluant la préparation de 13): 430 $/kg (60$/mol)
- 1-Chloro-2-nitrobenzene: 27$/kg (4.25$/mol)
- 1-Chloropentane-2,4-dione: 358 $/kg (48.17$/mol)
- Hydroxylamine: 25$/kg (4.1$/mol)
- Sodium Dithionite: 10$/kg (1.74$/mol)
- Sodium nitrite: < 10$/kg (< 1.74$/mol)
Avertissement
Ceci est un travail personnel réalisé sur papier uniquement et basé sur une étude bibliographique. Je ne suis aucunement responsable si quelqu’un souhaite essayer cette voie de synthèse et procédés, et rencontre toutes sortes de problèmes tels que blessures corporelles ou pertes pécuniaires, la liste n’étant pas exhaustive. Cette étude pouvant servir de base de travail est destinée à des chimistes expérimentés uniquement. Les essais doivent être effectués dans un laboratoire avec les installations appropriées garantissant la sécurité des manipulations et des individus.© David Le Borgne, 2015, spécialiste en développement et optimisation de procédés de synthèses.

Aucun commentaire:
Publier un commentaire